フロンティアサイエンス学部に関心がある高校生・受験生のみなさんは、生物か化学、あるいは両方が好きという方だと思います。
大学に進学したら生物や化学の学びはどのように変わるでしょうか?
生物は比較的、高校と大学の学びがシームレスになっているようですが、化学は全然違うと感じる方も多いようですね。
そこで、本日が最終日の前期末試験の科目から『有機合成化学』を例に挙げて、大学での化学の一面を紹介したいと思います。
この科目の試験では、「この化合物をつくりたい。何を原料につかって、どんな反応でつくることができるか?」という問題がよく出題されます。
高校では原料から生成物を考える、また、反応も1段階、という問いが多かったのではないでしょうか。
それに対して、『有機合成化学』では、手に入れたい物質(生成物)から原料を考える、また、その物質の構造も複雑なので必要な反応も多段階、という課題に取り組みます。
例えば、エステルを例にとると・・・
高校の化学(例)酢酸とエタノールを反応させると何が生じる?
(答:酢酸エチル)
大学の化学(例)オセルタミビル(インフルエンザ治療薬のタミフル)をシキミ酸からつくるにはどうしたらよい?
(答:長過ぎてここには書けませんのでオセルタミビル+ロシェ法でググってみてください。なお、これはあくまでも例であって、実際の授業ではググってそのまま答えがわかるような課題はでません。)
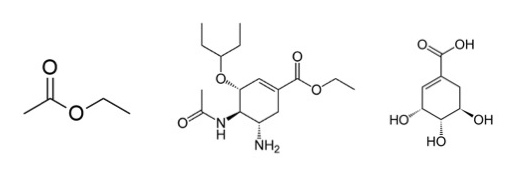
(左から、酢酸エチル、オセルタミビル、シキミ酸)
酢酸エチルとオセルタミビルには共通する構造がありますね。エステル結合といいます。
ですから、高校と大学の化学にはもちろん共通する内容もたくさんあるんです。ただ、大学ではさらに、いろいろな知識を組み合わせながら、生成物から原料の方に遡っていく考え方もトレーニングをする、ということです。
これは、化学という学問の動機の一つが「あれが欲しい! だからつくりたい!」というものだからですね。
貝から取れる綺麗な紫色の色素、樹皮から取れる薬、腸内細菌が作り出すビタミン ・・・ そういったものを「たくさん欲しい」「自分の手でつくりたい」そういう欲求が化学を発展させてきたんですね。